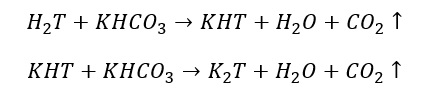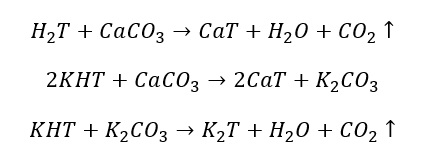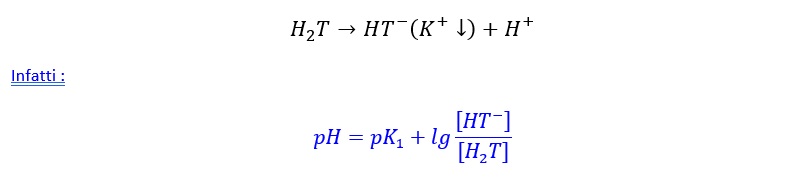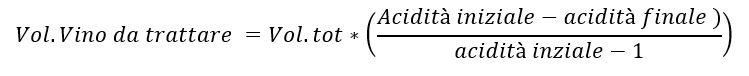Invitiamo a rileggere gli articoli precedenti per una maggior comprensione dell’argomento.
- pH ed Acidità
- Acidità Totale: Acidità Fissa ed Acidità Volatile
- pH nel Vino
- Correzione Acidità nel Vino
DISACIDIFICAZIONE
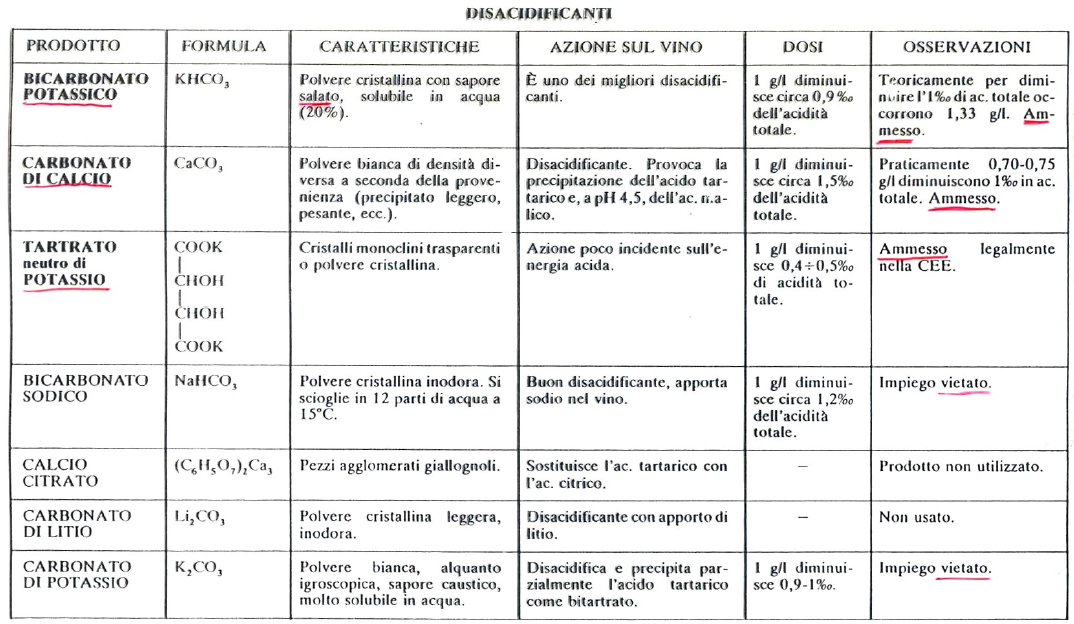
Per la DISACIDIFICAZIONE (chimica) si possono usare diversi composti. Vediamo ora una tabella con alcuni di questi e le loro caratteristiche:
DISACIDIFICAZIONE CON I CARBONATI
I più importanti sono essenzialmente i primi tre:
- Bicarbonato di Potassio: KHCO3
- Carbonato di Calcio: CaCO3
- Tartrato neutro di Potassio: K2 T ⇒ quando userò questo metodo dovrò stare attento visto che andrà ad aggiungere molto potassio (K) al mezzo andando a salificare gli acidi presenti.
I primi due composti sono i più usati per le disacidificazioni proprio perchè se userà il tartrato neutro di potassio si andrà ad immettere nel vino molto K che potrà salificare gli acidi presenti.
Quando invece si andrà a lavorare aggiungendo KHCO3 e CaCO3 si otterrà si una neutralizzazione degli acidi con conseguente aumento del pH MA, purtroppo, l’aggiunta provocherà la formazione di sali poco solubili che PRECIPITERANNO. Questa precipitazione ha un effetto sul risultato finale e quindi sul pH (sono difficili da prevedere).
I sali che si formeranno per reazione con l’acido tartarico o con il calcio (K+ p Ca++), mentre l’acidità risultante (H+ liberati) verrà eliminata come H2CO3 (acido carbonico), il quale in ambiente acido si decomporrà in CO2 e H2O (eliminato nell’aria).
Aggiungendo Bicarbonato Di Potassio si potranno apprezzare le seguenti reazioni:
In questo modo si neutralizzano gli acidi per salificazione, i quali passeranno da una forma libera ad una forma (parzialmente) salificata. I sali di potassio prodotti, come già specificato, sono sali POCO SOLUBILI che tenderanno a precipitare nel vino molto lentamente.
Se viene aggiunto invece del Carbonato di Calcio di avrà:
I sali derivanti che si formeranno in seguito all’uso di Carbonato di Calcio, a differenza di quelli da bicarbonato di potassio, saranno sali insolubili con precipitazione istantanea nel vino.
In questo modo il risultato desiderato, ossia l’aumento del di pH, è si raggiunto, ma provocheremo di conseguenza una precipitazione dei sali, istantanea se si useranno sali di calcio o nel tempo con l’uso di sali di potassio.
Ma quanti grammi di prodotti devo aggiungere per neutralizzare 1 grammo di acido tartarico (stechiometrico)?
Se userò il KHCO3 (Bicarbonato di Potassio) dovrò teoricamente aggiungere:
- 1,33 grammi di KHCO3
Se invece vorrò usare il CaCO3 (Carbonato di Calcio) ne devo aggiungere
- 67 grammi di CaCO3
Nel vino dovrò però tener conto anche dei fenomeni di precipitazione dei tartrati che andranno ad influire sul pH finale, rendendo tutti i calcoli appena visti molto semplicistici rispetto alla realtà.
Se consideriamo una precipitazione dei sali che si formeranno (sali di Ca o K, come per esempio il sale di bitartrato salificato con il potassio) non si potrà ignorare il fatto che il sistema andrà incontro a modifica, visto che i sali precipitati saranno eliminati dalla soluzione. Vengono quindi spostati gli equilibri (stechiometrico, guardando la formula) con produzione di H+ (⇒ diminuzione del pH, ossia acidificazione) secondo:
Una precipitazione di sale significa una diminuzione del numeratore [HT–] e quindi una diminuzione del pH, valore che andrà in senso opposto a quello che si era ottenuto con la neutralizzazione. La diminuzione del pH dovuta alle precipitazioni, però, non compensa l’aumento di pH dovuto alla neutralizzazione.
In poche parole, la precipitazione quindi mi modifica gli equilibri stechiometrici con producendo H+; questo comporta che le disacidificazioni, nel vino, sono meno efficaci di quello che si potrebbe calcolare su formula causa, appunto, le salificazioni e precipitazione dei sali.
Tuttavia bisogna considerare che gli effetti di precipitazione (con produzione di H+) hanno un’azione diversa a seconda del pH:
- MASSIMA INCIDENZA: la massima incidenza (in cui la concentrazione degli HT– è massima) la si ha quando siamo a pH 3,6 o 4 nel vino, a causa della presenza di etanolo e ioni;
- MINIMA INCIDENZA: la si ha a pH inferiori (<) di 3.5 ed, infatti, vini acidi hanno limitati effetti sulle salificazioni.
Anche il fattore temperature influisce in maniera imporrante, dove con il freddo favoriamo la precipitazione dei sali (stabilizzazione).
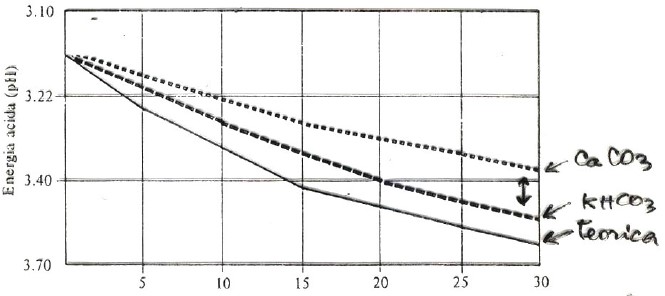
Ritornando alle sostanze usate per disacidificare un vino, bisogna ricordare che il CaCO3 (carbonato di calcio) ha un potere disacidificante minore di KHCO3 (bicarbonato di potassio); tuttavia i sali di Ca precipitano molto più velocemente (e tutti) rispetto ai sali di K, che necessiteranno di una stabilizzazione a freddo arrivando a risultato finale (disacidificazione) solo quando sono precipitati tutti.
In proporzione: 1 g/L di CaCO3 porta la diminuzione immediata di 1.5 g/L di acido tartarico.
In questa tabella possiamo vedere la diminuzione del pH di un vino con aggiunte crescenti di KHCO3 e CaCO3 (a parità di equivalenti impiegati).
Con le disacidificazioni con i carbonati nel vino, tuttavia, non andrà tutto liscio, ma riscontreremo alcuni problemi:
- Si formeranno sali con l’acido malico, visto l’eccesso di questo acido organico, i quali RESTERANNO SOLUBILI dando un GUSTO SALATO;
- Si diminuirà il rapporto tra tartarico e malico.
PRECIPITAZIONE DEL DOPPIO SALE
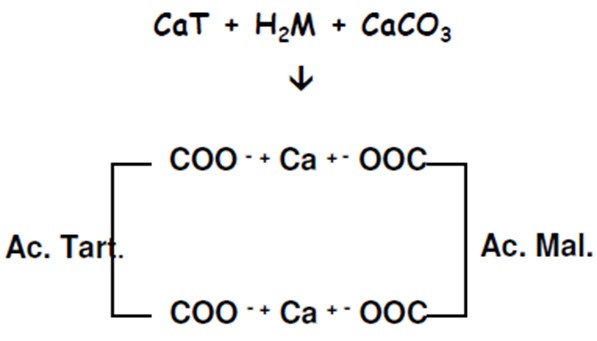
Potrebbe essere necessario, per questioni organolettiche, rimuovere una parte di acido malico e, quando il rapporto tra questi acidi sarà molto inferiore a 1 (<<1, soprattutto al nord), ai fini dell’eliminazione si utilizzerà la tecnica della PRECIPITAZIONE DEL DOPPIO SALE ⇒ in pratica devo far si che all’interno del vino si produca un sale di calcio doppio andando a formare il malato-tartrato di calcio insolubile.
Per formare questo doppio sale devo far si che le funzioni acide dell’acido malico e dell’acido tartarico siano libere (deprotonate), fenomeno che è apprezzabile solo a pH > 4,5, valore molto lontano rispetto a quello del vino (pH > 4.5 si deprotonato funzioni acide superando il pKa degli acidi).
Ma come possiamo, allora, attuare questa tecnica? Possiamo ottenere questa condizione usando una parte del vino, per esempio il 10% calcolato con una formula, versandolo su una miscela carbonato di Ca e tartrato di Ca, arrivando a pH > 5.1. A questo valore di pH si potrà assistere ad una precipitazione quasi immediata del doppio sale, fenomeno che allontanerà il malico; una volta allontanati i cristalli si prenderà quella quota del vino, quasi priva di acido tartarico e malico, per aggiungerla al resto diminuendo la quantità di acido malico totale (ho diminuito la quantità di malico sul 10% con effetto sul totale una volta messo insieme)
Per calcolare quanto vino bisogna trattare bisogna diventa fondamentale seguire questa formula:
TARTRATO NEUTRO DI K (K2T)
Un altro modo per disacidificare è l’uso di TARTRATO NEUTRO DI POTASSIO (K2T), che apporterà al vino K+ facendo precipitare una quota di acido tartarico (KHT), cambiando, di fatto, l’acidità titolabile. Per l’attuazione di questo metodo servono quantità molto alte di K2T, composto che costa molto.
Per diminuire l’acidità di 1 g/L servono 2 g/L di K2T, in pratica dosi che si aggirano tra i 150 – 300 g/hl e costose; l’effetto significativo sarà, poi, sull’acidità totale e non sul pH (poco effetto). È una tecnica che agisce parzialmente anche sull’acido acetico (acetato di K) eliminandone una piccola parte.
ESEMPIO:
Se abbiamo un vino a pH 2,8 dovrò disacidificare. Prendo 1 o 2 litri del vino da trattare e aggiungo diverse quantità di disacidificante (es 0,5 – 1 – 1,5 – 2 g), lasciando poi riposare dipendentemente da cosa uso. Se uso
- KHCO3 lascio a riposare a -4/-5 per 7 giorni;
- CaCO3 lascio a temperatura ambiente per 10 giorni.
Analizzo poi il vino e lo assaggio.
Le quantità teoriche per abbassare l’acidità di 1 g/L sono :
- 1,33 g/L di KHCO3
- 0,67 g/L di CaCO3
Buona Lettura
Vino&Viticoltura