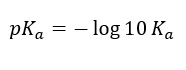Per una maggior comprensione invitiamo a leggere gli articoli precedenti in modo tale da avere un quadro più completo a fine lettura:
il pH nel mosto – vino è un’indicazione dell’entità della neutralizzazione degli acidi avvenuta durante la maturazione dell’uva o in seguito a trattamenti mirati. NON è CORRELATO alla quantità totale degli acidi, ma alla loro capacità di dissociarsi (forza e attività) con importanti contribuiti alle qualità organolettiche del vino; per esempio, nei vini, la sensazione incomincia ad essere pungente se il pH è < 3.00.
Vediamo ora di definire la differenza tra un acido ed una soluzione acida:
- ACIDO = composto qualsiasi che riesce a rilasciare ioni idrogeno in soluzione;
- SOLUZIONE ACIDA = soluzione la quale acidità dipende da quanti acidi ci sono e quanti di questi acidi sono forti (dissociati).
Ma seguendo la definizione di soluzione acida, come mosto e vino, come si fa a dire quanti ioni idrogeno riesce liberare un determinato acido?
Per capire questo importantissimo parametro, che influenza direttamente la soluzione visto che l’acidità è dipesa sia dalla concentrazione di acidi che dal grado di dissociazione di questi, bisogna guardare la COSTANTE DI DISSOCIAZIONE dell’acido che vogliamo prendere in considerazione. La costante di dissociazione (Ka) di un acido si esplica secondo questa formula:
Formula che andrà ad introdurre il concetto di FORZA DI UN ACIDO:
- Se la Ka sarà bassa l’acido non si dissocerà completamente e saremmo in presenza di un acido debole.
- Se la Ka sarà alta l’acido si dissocerà completamente e saremmo in presenza ad un acido forte.
Negli acidi deboli gli ioni H+ sono legati con legami molto forti non permettendo una completa dissociazione, mentre negli acidi forti la dissociazione avviene completamente.
È bene sapere che quando un acido si dissociata in soluzione sarà possibile trovarlo sotto tre diverse forme:
- BASE CONIUGATA
- IONI H+
- ACIDO IN FORMA DISSOCIATA
Sarà l’equilibrio tra queste tre forme che mi permetterà di dire se sarò davanti ad un acido debole o forte.
Ka e pKa
Quando andremo a lavorare con soluzione acide non si parlerà quasi mai di Ka se non in riferimento all’acido puro preso in considerazione, ma si considererà l’inverso del logaritmo in base 10, cosa che si esplica con l’uso della pKa e con la generazione di numeri più gestibili.
Per i valori, poi, funziona come il pH:
- ACIDO FORTE: Ka alto e pKa basso;
- ACIDO DEBOLE: Ka basso e pKa
Ma perché ci interessa così tanto il grado di acidità? Perché questo valore condiziona diversi parametri come, ad esempio, i valori di pKa (acidità) che mi condizionano il GRADO DI SALIFICAZIONE di vari acidi nel vino. Gli acidi più forti, come ad esempio il tartarico (pKa = 3.1), tenderanno a salificare prima e in maniera maggiore rispetto ad altri acidi più deboli, come l’acetico (pKa = 4.7).
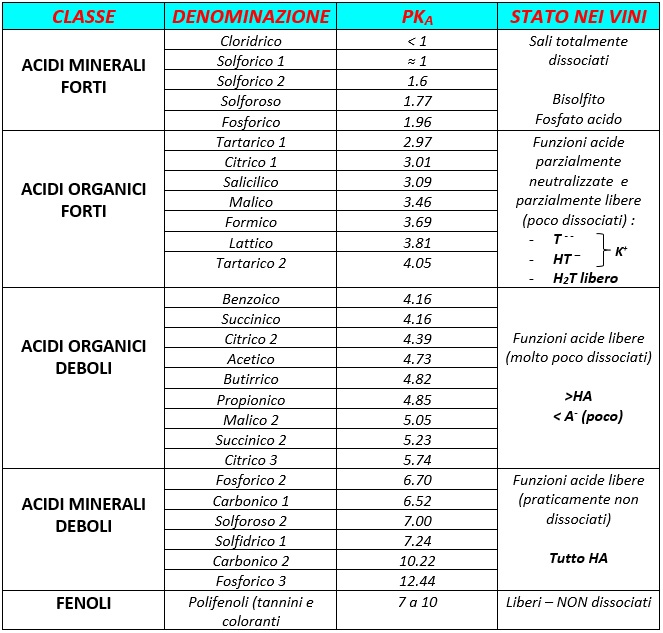
Vediamo ora una tabella su come si possono presentare gli acidi in soluzione:
Buona Lettura
Vino&Viticoltura