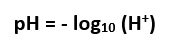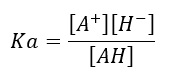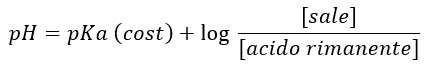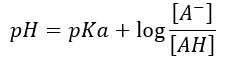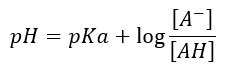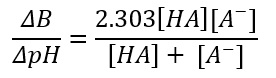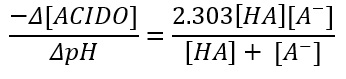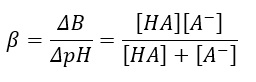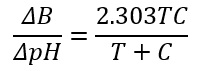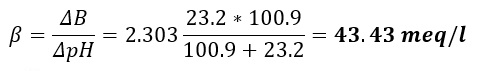pH
il pH serve per farci capire l’acidità reale del vino visto che questo parametro ci dice l’attività degli ioni idrogeno presenti in una soluzione (attività correlata alla concentrazione); viene espresso come:
e viene misurato con uno strumento chiamato pH – metro (dopo taratura).
Il pH del vino è compreso tra 2,8 a 4.0 e nel mosto varia in relazione a maturità, cultivar, produzione/ha, andamento stagionale, disponibilità acqua, dal potassio portato dentro all’inizio (per le salificazioni). Deriva dall’equilibrio di dissociazione dei vari acidi presenti (AH) secondo questa reazione:
E la capacità di liberare H+ definirà l’acidità (forte o debole) di un determinato acido AH. La capacità di dissociazione dipende dal valore della costante di equilibrio di AH ↔ A–+H+, che si indica come Ka ed è espressa dalla seguente equazione:
Più alta è la Ka di un acido (più basso il pKa) e più l’acido tenderà e dissociarsi liberando H+ e più l’acido sarà forte. Da ricorda re che il pKa = – log10 Ka, il che vuol dire che ad alti Ka corrisponderanno pKa bassi.
Bisogna considerare che il pH varia anche durante la vinificazione per le variazioni nelle costanti di equilibrio (ogni acido ha il suo pKa, una costante che è dipesa dal solvente) dovute alla presenza dell’etanolo, alla precipitazione dei sali degli acidi, del consumo di acido malico e amminoacidi ed alla produzione di acido succinico oltre che alla esterificazione parziale dell’acido tartarico.
Gli effetti del pH si possono vedere sulla ionizzazione dei componenti ionizzabili, sulla velocità e tipologia delle reazioni chimiche e biochimiche, sul cambiamento chimico – fisico del mezzo e sull’attività microbiologica; il pH diventa quindi fondamentale non solo dal punto di vista organolettico visto che se si riesce a tenere bassi i valori del pH aumenteranno la stabilità chimico – fisica e microbiologica del vino (viene anche potenziato l’effetto dell’anidride solforosa).
SITUAZIONE NEL MOSTO E NEL VINO
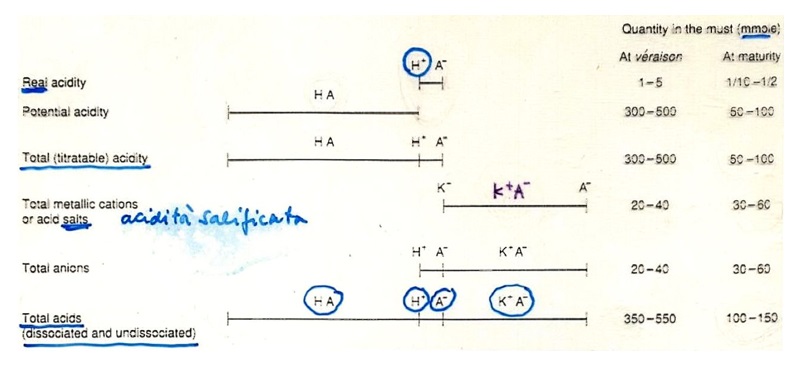
Vediamo ora la situazione degli acidi e delle loro forme in ambiente mosto / vino:
I mosti ed i vini sono delle soluzioni acido – basiche nelle quali sono presenti acidi deboli AH, che libereranno ioni idrogeno H+ in presenza dei loro sali A–, i quali si comporteranno come basi forti accettando protoni (gli acidi tendono a formare sali in relazione al loro pKa). Gli acidi, quindi, tendono a formare sali in relazione al loro pKa e gli acidi forti avranno la precedenza in questa reazione di dissociazione e salificazione.
Ma esiste una certa CAPACITÀ TAMPONE nel mezzo che riesce ad opporsi a variazioni di pH sensibili in seguito a variazioni della composizione (soluzione tampone si ha quando troviamo un acido debole in presenza di un suo sale); IL POTERE TAMPONE ha degli effetti importantissimi in quanto (1) DETERMINA LA STABILITÀ DEL VINO sia dal punto di vista chimico – fisico, microbiologico e organolettico, ed incide sulle pratiche di modificazione dell’acidità totale visto che modificare il pH in un vino con alta capacità tampone sarà più difficile che procedere in un vino con bassa capacità tampone.
Ma vediamo come si gestisce il pH in una soluzione come il mosto o il vino. Il pH di una soluzione contente un acido monoacido debole e il suo sale con una base forte (A–), soddisfa l’equazione di Anderson – Hasselbach che dice:
Ossia:
Quindi il pH sarà determinato dal logaritmo del rapporto delle concentrazioni tra anione A– ed acido indissociata AH, essendo il pKa una costante tipica dell’acido.
In realtà nel vino le cose sono molto più complicate visto che gli acidi sono bi – acidi e sono presenti più specie acide, rendendo impossibili stime perfette e facendoci ricadere sull’approssimazione. Si presuppone, infatti, che gli effetti dei diversi acidi siano additivi e che gli stati di salificazione siano indipendenti, il che non è vero esistendo una interazione tra i diversi acidi.
Inoltre bisogna tener conto che il pKa degli acidi nel vino è diverso da quello degli stessi acidi in soluzioni acquose ideali visto che si ha la presenza di zuccheri di alcol, cosa che determina un aumento di 0.15 – 0.2 unità nel valore di pKa dovuto a cambiamenti nella costante dielettrica del solvente che ha effetto sulla forza del legame all’interno del gruppo carbossilico. Bisogna inoltre considerare la presenza di altri ioni in soluzione (misurata come forza ionica ) che ha un effetto sull’attività di uno ione, valore che verifica rigorosamente la legge di azione di massa (invece di riferirsi alla concentrazione). L’attività dipende, oltra che dalla concentrazione, anche dal coefficiente di attività, a sua volta dipeso dalla forza ionica che nel vino è di circa 80 mM.
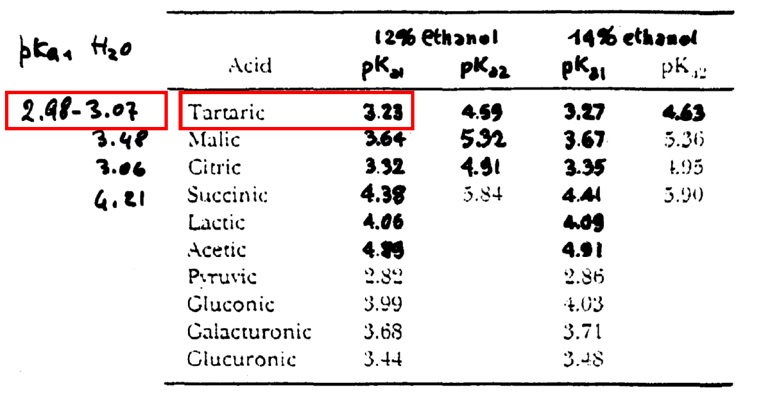
Vediamo ora come si modificano i valori di pKa per certi acidi in soluzione alcolica (si indeboliscono):
In seguito a questi fenomeni appena (presenza di etanolo e attività ionica) visti possiamo affermare che la massima concentrazione dello ione bitartrato HT– nel vino la si ha a pH 4.1 e non a 3.6 – 3.7 come in acqua; da notare l’importantissima differenza.
Quindi le varie forme di acidi aumentano o diminuiscono la loro costante di dissociazione nel vino rispetto ad una soluzione con sola acqua.
CAPACITÀ TAMPONE
Possiamo affermare che UNA SOLUZIONE TAMPONE È UNA SOLUZIONE CHE CONTIENE UN ACIDO DEBOLE ED IL SUO SALE CON UNA BASE FORTE:
E se a questo livello di equilibrio si aggiunge una base si provoca la variazione del rapporto visto l’aumentare della quota dell’anione salificato.
Per esempio: se aggiungiamo NaOH neutralizziamo l’acido per il 99%, ossia resterà una sola molecola di acido indissociato (AH)/100 molecole di acido dissociato (A–); si avrà quindi
In questo modo il pH supererà di due unità il pKa dell’acido.
Guardando all’equazione, quando la quantità di acido salificato [A–] è uguale alla quantità dell’acido libero [AH] il rapporto sarò uguale a 1, e così facendo il logaritmo del rapporto diventerà 0. Se inseriamo lo zero nell’equazione precedente al posto del termine , il pH diventerà uguale al pKa à pH = pKa.
Intorno a questo valore di pH (+/- 1) il sistema avrà la massima capacità tampone o, spiegato diversamente, la massima capacità tampone di un sistema la si ottiene quando il pH ha lo stesso valore del pKa dell’acido presente; per esempio a pH = 3 l’acido tartarico (pKa = 3) ha la massima capacità tampone, ossia ha la massica capacità di opporsi alla variazione di pH con l’aggiunta di acidi o basi. Infatti se voglio fare una soluzione tampone con pH = 3 dovrò usare un acido con pKa di 3 e usando un acido con pKa = 8 non tampono nulla.
Nel vino comunque non si avrà solo l’acido tartarico, ma molti altri acidi. Allora come si manifesta la capacità tampone del vino?
Essendo l’equazione di Anderson – Hasselbach applicabile anche a mosti e vini, ed essendo presenti, in queste soluzioni, acidi di – acidi (con due funzioni acide), si più assumere che le due funzioni si comportino come indipendenti; in pratica TUTTI GLI ACIDI PRESENTI CONTRIBUIRANNO ALLA CAPACITÀ TAMPONE, la quale si potrà dedurre dalla CURVA DI TITOLAZIONE.
La curva di titolazione si ottiene registrando le variazioni di pH che si ottengono aggiungendo quantità crescenti di una base nota; infatti è possibile descrivere una curva di titolazione con l’aggiunta della soda e segnando le variazione di pH, il quale se varierà di poco ci dirà che staremo agendo sul potere tamponante della soluzione, mentre se la variazione risulterà più significativa vorrà dire che saremo usciti dalla zona tampone.
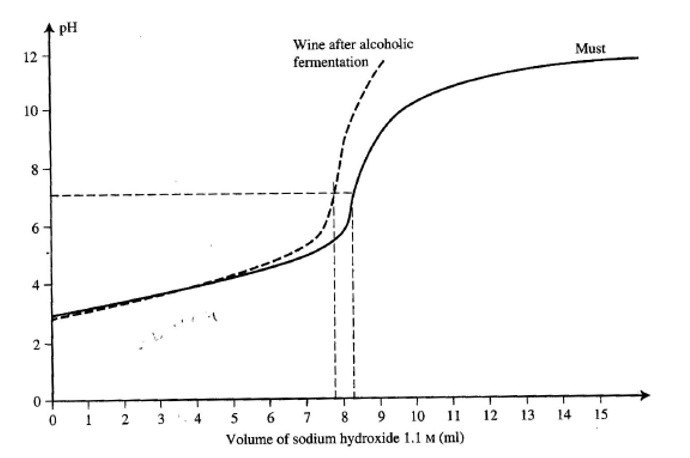
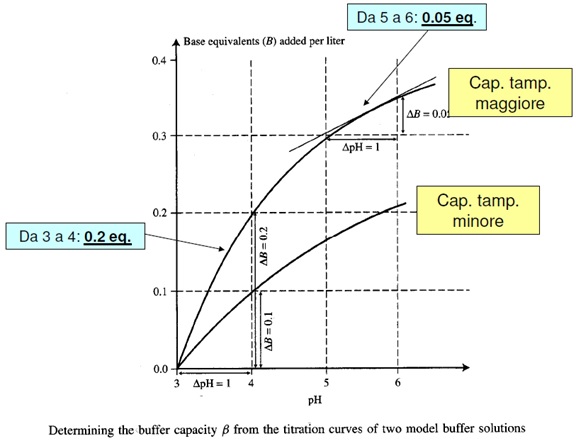
Vediamo ora il grafico.
È possibile notare come le curva del mosto e del vino non abbiano punti i inflessione, corrispondenti al pKa dei diversi acidi : c’è la sovrapposizione delle loro capacità tamponanti e le curve si presenteranno lineari fino al 90% dell’acidità neutralizzata (pH = 6.5 circa).
Infatti dal valore 0 a circa 6/7 il sistema tampona, caratteristica espressa dalla minima variazione d pH (quasi lineare). Si arriva comunque ad un punto in cui basta aggiungere pochissimo idrossido di sodio per modificare di tantissimo il pH uscendo, di fatto, dal range del tampone.
È qui possibile notare (dalle curve) come nel vino (e mosto) sia possibile tamponare per un grande range di pH, ossia da 3 a 7, 4 unità di pH tamponate; ma perché? Se in queste soluzioni avessimo un acido solo si potrebbe apprezzare una soluzione tamponante solo vicino solamente alla pKa dell’acido presente; nel vino, invece, il range di pH del potere tamponante spazia di 4 unità grazie alle sovrapposizioni delle varie curve ( o pKa) di tutti gli acidi presenti del vino.
Grazie quindi alla sovrapposizione del diverso potere tamponante dei vari acidi nel vino, la soluzione contrasta l’aumentare del pH dal valore di 3 a 7 (conferisce al vino questo range di potere tamponante).
Il potere tamponante si esaurisce a pH 7 a causa della mancanza di acidi con pKa tale da agire in quel range.
Comunque sia da questa curva di titolazione si possono vedere due cose:
- Il vino ha un acidità titolabile (pH 7) minore di quella del mosto, ossia per arrivare a pH 7 nel vino consumiamo meno soda che per il mosto
- Il mosto ha un potere tamponante maggiore del vino.
È quindi più facile correggere il pH del vino piuttosto di quello del mosto.
CALCOLO DELLA CAPACITÀ TAMPONE
Per la “correzione di acidità” diventa importantissimo sapere “quanto tampona un sistema”. La capacità tampone è definita come la quantità di protoni per litro necessari per spostare il pH di un unità o quanto acido ci serve per spostare il pH di un unità.
Normalmente si misura in
- Moli H+ (o OH–) / litro / unità di pH à M/L/pH
Nel mosto e nel vino si esprime come
- Millimoli / litro / unità di pH à mM/L/pH
Nel mosto e nel vino è generalmente
- 30-50 millimoli/ L/ pH , dove si hanno, come valori estremi 25-60 estremi.
Ma vediamo come calcolare matematicamente la capacità tamponante nel vino usando la seguente formula:
Dove
- ΔB sono gli equivalenti di base forte necessari per causare un aumento del pH pari a ΔpH;
- HA è l’acidità titolabile,
- A–acidità delle ceneri.
Nel caso si voglia aggiungere un acido si dovrà cambiare il segno, ossia si avrà
Poiché, in questo caso, il pH diminuisce.
(si calcola differenziando l’equazione di Anderson – Hasselbach pH = pKa + log [A–]/[HA], scritta come pH = pKa + lg [A–]- lg[HA] dopo trasformazione in log naturale (log10x2.303)
La quantità di base necessario per una variazione di un punto di pH di una soluzione di una miscela di acidi dipenderà quindi dalla sommatoria delle quantità di base necessarie per ogni singolo acido in forma libera (HA) e combinata (A–). Tuttavia se :
- La sommatoria di tutti gli acidi liberi (HA) è uguale all’ACIDITÀ TOTALE (T),
- La sommatoria di tutti gli acidi combinati (A–) è uguale all’ALCALINITÀ DELLE CENERI (C),
si potrà sostituire nell’equazione:
Si potrà scrivere:
Essendo T e C noti si potrà calcolare, con buona approssimazione, la capacità tampone della soluzione.
ESEMPIO :
abbiamo un vino con pH = 3.23, dove l’acidità totale = 100,9 meq/l e l’alcalinità delle ceneri = 23.2 meq/l; il potere tampone sarà di:
Questo ci dice che un’aggiunta di 43.43 meq di base forte (KOH, K bicarbonato o Ca carbonato) provocheranno un aumento di 1 punto (da 3.23 a 4.23) di pH. Per avere un aumento di 0.1 punti di pH basterà quindi aggiungere 4.34 meq di disacidificante.
Più praticamente si potrà ricavare il potere tampinante di un vino regestando il numero di equivalenti di base (o acido) necessari per ottenere una variazione di un puto o mezzo punto di pH di un litro di mosto vino, specificando sempre l’intervallo di pH al quale si opera (poiché la capacità tampone varia seconda del pH).
Buona Lettura
Vino&Viticoltura